
◆技术简介
实时荧光定量PCR(real-time quantitativePCR),是指在PCR反应体系中加入荧光染料SYBR或荧光标记的特异性探针,利用荧光信号的积累实时在线监控PCR反应过程,由于在PCR扩增基因的Ct值和该模板的起始拷贝数存在线性关系,所以成为定量的依据,可以实现对目的基因在样本中的相对定量或绝对定量。荧光定量PCR不仅实现真正实现了绝对定量,而且具有灵敏度和特异性、高能实现多重反应、自动化程度高、无污染、实时和准确等特点。随着生物芯片技术和荧光探针定量技术的结合,实时荧光定量PCR在医学检测及其他各个领域中的应用前景十分广阔。
根据Real-time qPCR所使用荧光化学物质有荧光染料和荧光探针两类,根据使用荧光物质不同,该技术常用的方法有SYBR Green染料法和TaqMan探针法。
█ SYBR Green染料法
|
█ TaqMan探针法
| |
SYBR Green I是目前主要使用的荧光染料分子,SYBR Green I是一种能与DNA双链小沟的特异性结合染料。游离的SYBR Green I几乎没有荧光信号,而结合双链DNA后,则会发射荧光信号。在荧光定量PCR扩增过程中,随着PCR循环数的递增,PCR产 物不断积累,荧光信号也会相应的增加,其荧光信号强度代表双链DNA分子的数量。 | TaqMan探针是最常用的Real-time qPCR中荧光探针为,根据目的基因设计合成特异性的探针,该探针的5'端标记荧光基团,3'端标记淬灭基团。正常情况下两个基团的空间距离很近,荧光基因因淬灭而不能发出荧光。当PCR扩增扩增延伸到探针结合的位置时,Taq酶利用5'外切酶活性,将探针5'端连接的荧光分子从探针上切割下来,从而使其发出荧光。检测到的荧光分子数与PCR产物的数量成正比。 |
◆实验方法
实验方法 | 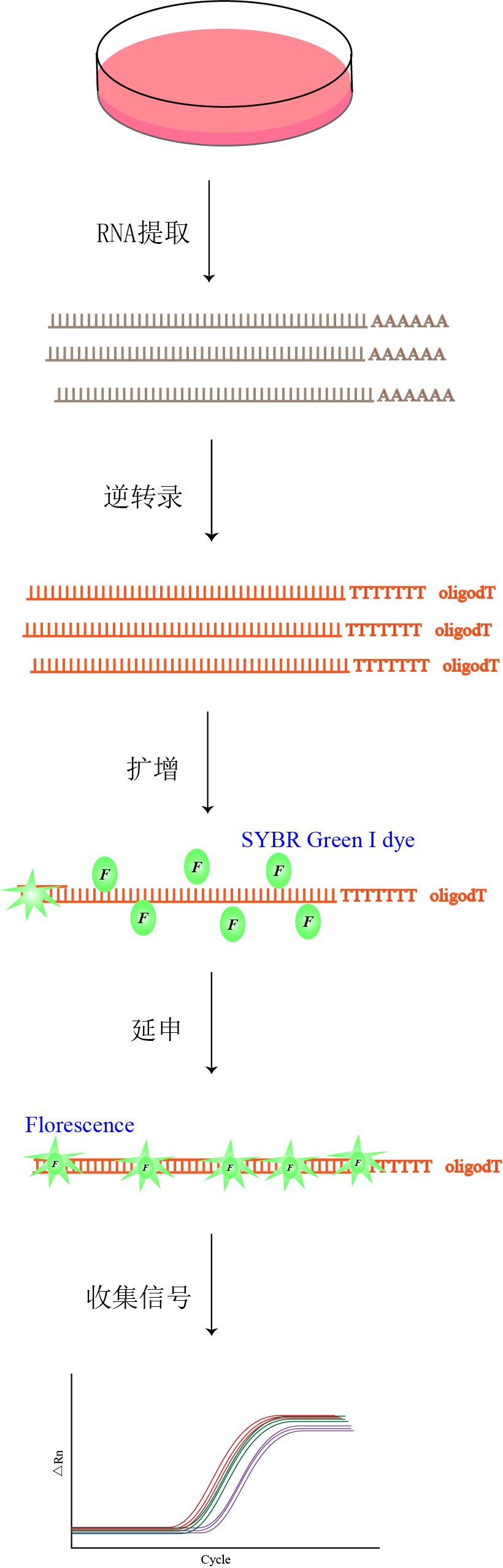 |
① 引物设计:根据目的基因序列分别设计特异性的引物或者荧光探针; ② RNA抽提:提取各样本DNA/RNA、RNA反转录、跑电泳、测浓度; ③ 反转录:去基因组DNA,RNA反转录; ④ RealTime PCR(荧光定量PCR)扩增:配置PCR反应体系,加入模板、引物、染料和dNTP等体系所需的溶液; ⑤ 数据处理,进行扩增曲线、溶解曲线、表达量差异等分析。 | |
数据处理方法 | |
① 检测不同样本待测基因的表达差异,需要通过内参基因的CT值来平衡这些实验差异,获得-△CT值。即:检测基因CT值的平均数-内参基因CT值的平均数。 -△CT=-【Mean(检测基因CT值)-Mean(内参基因CT值)】 ② 对于两个样本间同一个检测基因表达量差异的计算公式为: -△△CT=-(△CT样本1 -△CT样本2)=-【样本1(检测基因CT-内参基因CT)】-【样本2(检测基因CT-内参基因CT)】。 ③ 数据采用2-ΔΔCt法来计算。 |
◆服务内容
服务类型 | 客户提供 | 服务内容 | 周期 | 价格 |
RT-qPCR 相对定量 | ² 实验样本 ² 实验信息表 | Ø 引物设计 Ø RNA抽提和反转录 Ø 上机PCR检测 Ø 数据实验报告 | 5-6周 | |
RT-qPCR 绝对定量 | ² 实验样本 ² 实验信息表 | Ø 引物设计 Ø 标准品制备和标准曲线制备 Ø RNA抽提和反转录 Ø 上机PCR检测 Ø 数据实验报告 | 5-6周 |
◆结果展示
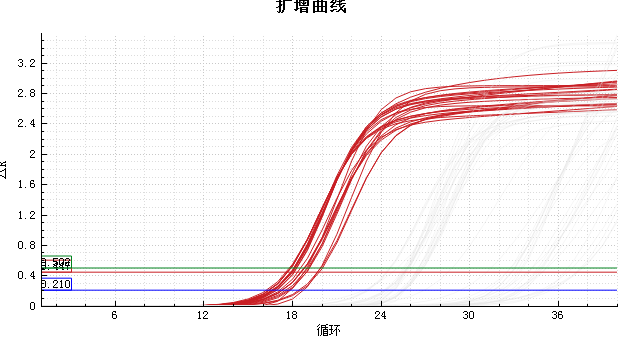 | 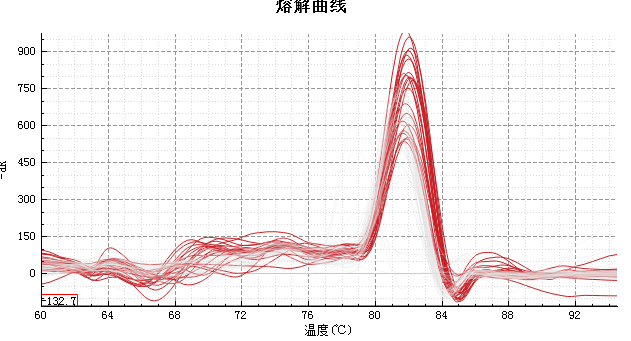 |
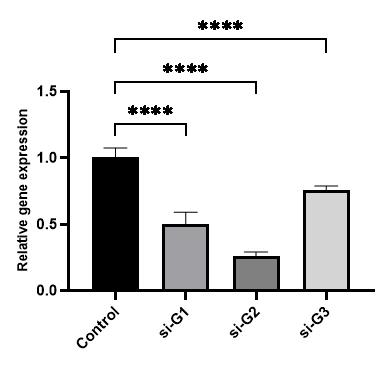 | |
◆服务流程
◆ 样本类型
1. RNA样品
提供的RNA总量不低于10ug,浓度不低于200ng/ul,尽量大于500ng/µl。A260/280应在1.8-2.0之间。需提供RNA质量检测图,变性凝胶电泳应呈现两条清晰的带。样本放入-80℃冰箱中贮存,干冰运输。
2. 组织样品
组织离体15分钟内,立即将其用消毒过的刀具切成黄豆大小(直径约0.5cm)的小块,用PBS或生理盐水洗净血液、体液等影响实验结果的残留成分。随后将样本小块置于液氮中速冻,放入EP管中保存,再放入-80℃冰箱中或者液氮罐中保存,干冰运输。
3. 细胞
3.1 贴壁细胞
吸净培养容器中的培养基,并加入PBS,用细胞铲将细胞刮入离心管中(或加入适量PBS清洗1次细胞后用胰酶消化细胞,加入血清终止反应后收集于离心管中),离心去掉上清,再加入PBS清洗细胞2次,离心后样本放入液氮或-80度冰箱中保存,细胞总量不低于107个。
如果要裂解样本,吸净培养容器中的培养基,并加入PBS洗几次后弃去PBS,加入适当体积的裂解液(依据裂解液说明书),用细胞铲将细胞刮入裂解液中。将细胞裂解液转移到样品管中。
3.2 悬浮细胞
将细胞悬液转移至样品管中,离心弃掉上清。去除上清后用PBS清洗细胞2-3次,直至把所有的培养基去除干净;将离心后的细胞放入液氮或-80℃冰箱中保存。细胞总量不低于107个。
样本放入-80度冰箱中暂存。加入适当体积的裂解液(依据裂解液说明书)。反复吹吸直至清亮。
4. 细菌悬液
将细菌悬液转移至样品管中离心,去除上清培养基,再用PBS清洗三次,清洗干净后,将菌体沉淀转移至1.5ml的EP管中,封口膜封口,管子上做好标记,将样品放入-80℃冰箱中保存,干冰运输。
如果要裂解样本,加入适当体积的裂解液(依据裂解液说明书)。反复吹吸直至清亮。
5. 血液样品
5.1 全血
采集新鲜血液放置抗凝管或血袋中保存,样本量大于2ml,需当天送达,4℃运输。或者新鲜血液分离白细胞,分离后的白细胞样本放入-80℃冰箱中保存,干冰运输。
如需提取RNA,建议采用专用的全血样品RNA提取试剂盒抽提RNA,如QIAamp RNA Blood Mini Kit。
5.2 血清
使用非抗凝管(或无热原无内毒素的离心管)采集血液样本,室温下静置1-3个小时不等或4℃静置过夜使其自然凝固,2000-3500转/分4℃低温离心10-20min,吸取收集上清,血清需要量为200ul,如量较多建议分装保存,避免反复冻融,-80℃冰箱中保存,干冰运输。
如需裂解样品,按每200uL血清加入1ml Trizol的比率加入足量Trizol,涡旋摇匀,放入-80℃冰箱保存,干冰运输。
5.3 血浆
使用抗凝管(可根据样本选择EDTA、肝素钠、柠檬酸钠或枸橼酸纳作为抗凝剂)采集血液样本,混合10-20分钟后,2000-3000转/分4℃条件离心20分钟(或4000转/分离心5min),仔细吸取收集上层液体,血清需要量为200ul,如量较多建议分装保存,避免反复冻融,-80℃冰箱中保存,干冰运输。
如需裂解样品,按每200uL血清加入1ml Trizol的比率加入足量Trizol,涡旋摇匀,放入-80℃冰箱保存,干冰运输。